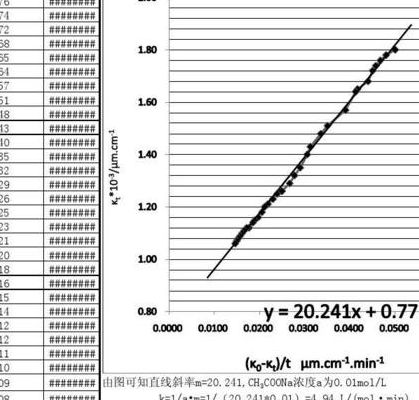
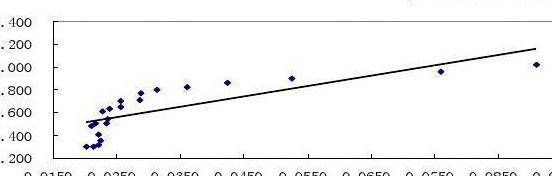
乙酸乙酯皂化反应速率常数的测定实验数据
1、浓度约为0.01mol/L。用精度0.1mg天平准确称量邻苯二甲酸氢钾,对氢氧化钠溶液进行浓度标定。得到准确的浓度C0后,计算等摩尔量的分析纯乙酸乙酯体积V。
2、乙酸乙酯的皂化反应是一个典型的二级反应,反应方程式为:CH3COOC2H5 + OH- → CH3COO- + C2H5OH。用NaOH溶液作催化剂,在实验温度下,该反应的速率方程为:v = k2[CH3COOC2H5][OH-]。
3、液至测定管,准确加入20ml乙酸乙酯溶液至测定管另外一侧,放入pH计,记录不同时间t的pH值。每分钟测定一次,测25分钟。5).重复上述操作,测定40℃时的pH值。6).处理、计算反应速率常数k和表观活化能Ea。
4、|反应物比例|反应速率常数/k| |---|---| |1:1牋牋爘0.0042牋牋牋| |2:1牋牋爘0.0076牋牋牋| |3:1牋牋爘0.0104牋牋牋| 可以看出,随着乙酸乙酯浓度的增加,反应速率常数也随之增大。
5、乙酸乙酯皂化反应速率常数的标准值:25℃时是42L/molmin;35℃时是19411L/molmin。
如何测定乙酸乙酯皂化反应速率常数?
1、液至测定管,准确加入20ml乙酸乙酯溶液至测定管另外一侧,放入pH计,记录不同时间t的pH值。每分钟测定一次,测25分钟。5).重复上述操作,测定40℃时的pH值。6).处理、计算反应速率常数k和表观活化能Ea。
2、用大肚移液管准确量取50.00mL氢氧化钠溶液置于反应器中,磁力搅拌器缓慢搅拌,温度恒定后,测定电导率κ0。计算出所需乙酸乙酯的用量,用量程为10~100μL的移液器量取。
3、乙酸乙酯的皂化反应是一个典型的二级反应,反应方程式为:CH3COOC2H5 + OH- → CH3COO- + C2H5OH。用NaOH溶液作催化剂,在实验温度下,该反应的速率方程为:v = k2[CH3COOC2H5][OH-]。
4、电导法是一种常用的测定化学反应速率常数的方法,它可以用于测定乙酸乙酯皂化反应的速率常数,原因是:乙酸乙酷皂化反应是一个二级反应,其反应方程式为:CH;COOCH5+NaOH-CH;COONa+CH;OH。
乙酸乙酯皂化反应速率常数的测定数据处理
浓度约为0.01mol/L。用精度0.1mg天平准确称量邻苯二甲酸氢钾,对氢氧化钠溶液进行浓度标定。得到准确的浓度C0后,计算等摩尔量的分析纯乙酸乙酯体积V。
乙酸乙酯皂化反应速率常数的测定数据处理的方法是电导法。用电导法测定浓度的依据是:溶液中乙酸乙酯和乙醇不具有明显的导电性,它们的浓度变化不致影响电导的数值。
乙酸乙酯皂化反应速率常数的测定实验数据是CH3COOC2H5OH+Na++OH-→CH3COO-+C2H5OH+Na+。实验步骤:调节恒温槽温度为25℃。仪器校正,打开电导率仪,预热十五分钟。调节常数旋钮,使仪器所显示值是所用电极常数值。
乙酸乙酯的皂化反应是一个典型的二级反应,反应方程式为:CH3COOC2H5 + OH- → CH3COO- + C2H5OH。用NaOH溶液作催化剂,在实验温度下,该反应的速率方程为:v = k2[CH3COOC2H5][OH-]。
|反应物比例|反应速率常数/k| |---|---| |1:1牋牋爘0.0042牋牋牋| |2:1牋牋爘0.0076牋牋牋| |3:1牋牋爘0.0104牋牋牋| 可以看出,随着乙酸乙酯浓度的增加,反应速率常数也随之增大。
实验目的。学习电导法测定乙酸乙酯皂化反应速率常数的原理和方法以及活化能的测定方法。了解二级反应的特点,学会用图解计算法求二级反应的速率常数。熟悉电导仪的使用。实验步骤。
文章声明:以上内容(如有图片或视频亦包括在内)除非注明,否则均为网友提供或互联网,转载或复制请以超链接形式并注明出处。