原电池的原理是什麽?
原电池的原理包括:化学反应、电子转移、离子移动、电动势。化学反应:原电池的核心是化学反应。在原电池中,两种不同的金属(通常是活泼性不同的金属)被放置在电解质溶液中,并连接成一个闭合电路。
原电池是一种利用化学能转化为电能的装置,其原理:化学能转化为电能、电子传递、氧化还原反应、电解质。化学能转化为电能:原电池的本质是将化学能转化为电能。在原电池中,化学反应将电子从负极传递到正极,从而产生电流。
原电池原理是通过氧化还原反应而产生电流,也可以说是将化学能转变成电能。有的原电池可以构成可逆电池,有的原电池则不属于可逆电池。原电池放电时,负极发生氧化反应,正极发生还原反应。
原电池是利用什么原理的电池?
原电池的原理包括:化学反应、电子转移、离子移动、电动势。化学反应:原电池的核心是化学反应。在原电池中,两种不同的金属(通常是活泼性不同的金属)被放置在电解质溶液中,并连接成一个闭合电路。
原电池是利用两个电极的电势不同,产生电势差,从而使电子流动产生电流,是一种将化学能转化成电能的装置。由于各种型号的原电池氧化还原反应的可逆性很差,放完电后,不能重复使用,故又称为一次电池。
通过氧化还原反应而产生电流的装置称为原电池,也可以说是把化学能转变成电能的装置。有的原电池可以构成可逆电池,有的原电池则不属于可逆电池。原电池放电时,负极发生氧化反应,正极发生还原反应。
原电池的原理
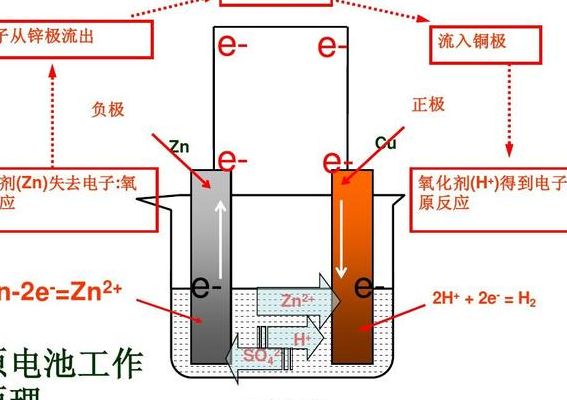
1、原电池的工作原理是利用化学能转化为电能的装置,通过氧化还原反应将化学能转变为电能。氧化还原反应是原电池工作的基础。在原电池中,正极和负极之间通过电解质连接,形成了一个闭合回路。
2、原电池中,电解质溶液中的阳离子向正极移动。外电路中电子由负极流向正极;内电路(电解质溶液)中阴离子移向负极,阳离子移向正极;电子发生定向移动从而形成电流,实现了化学能向电能的转化。
3、原电池的工作原理如下:电极材料由两种金属活泼性不同的金属或由金属与其他导电的材料(非金属或某些氧化物等)组成。电解质存在。两电极之间有导线连接,形成闭合回路。发生的反应是自发的氧化还原反应。
4、从能量转化角度看,原电池是将化学能转化为电能的装置;从化学反应角度看,原电池的原理是氧化还原反应中的还原剂失去的电子经外接导线传递给氧化剂,使氧化还原反应分别在两个电极上进行。
5、原电池原理是通过氧化还原反应而产生电流,也可以说是将化学能转变成电能。有的原电池可以构成可逆电池,有的原电池则不属于可逆电池。原电池放电时,负极发生氧化反应,正极发生还原反应。
原电池的工作原理
1、原电池的原理包括:化学反应、电子转移、离子移动、电动势。化学反应:原电池的核心是化学反应。在原电池中,两种不同的金属(通常是活泼性不同的金属)被放置在电解质溶液中,并连接成一个闭合电路。
2、原电池的工作原理如下:电极材料由两种金属活泼性不同的金属或由金属与其他导电的材料(非金属或某些氧化物等)组成。电解质存在。两电极之间有导线连接,形成闭合回路。发生的反应是自发的氧化还原反应。
3、原电池 通过氧化还原反应而产生电流的装置称为原电池,也可以说是将化学能转变成电能的装置。有的原电池可以构成可逆电池,有的原电池则不属于可逆电池。原电池放电时,负极发生氧化反应,正极发生还原反应。
4、从能量转化角度看,原电池是将化学能转化为电能的装置;从化学反应角度看,原电池的原理是氧化还原反应中的还原剂失去的电子经外接导线传递给氧化剂,使氧化还原反应分别在两个电极上进行。
文章声明:以上内容(如有图片或视频亦包括在内)除非注明,否则均为网友提供,转载或复制请以超链接形式并注明出处。