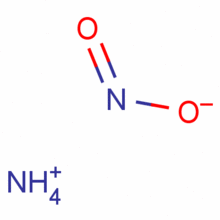
亚硝酸铵为什么不能制氨气?
1、氧化性酸的铵盐受热时,发生氧化还原反应,通常生成氮气,即氨被氧化。
2、因为NH4NO3是氧化性铵盐,加热时低温生成NH3和HNO3,随着温度升高,硝酸的强氧化性发挥作用使生成的氨进一步被氧化生成氮气和氮的氧化物,所以不能用NH4NO3跟Ca(OH)2反应制氨气。
3、硝酸铵加热会分解生成氮氧化物甚至发生爆炸;碳酸氢铵加热会分解生成水,使得生成的氨气不干燥。所以制备氨气一般用氯化铵,它不仅便宜,而且不会给氨气引入杂质(氯化铵受热分解会生成氯化氢,但是会被氢氧化钙吸收掉)。
4、硫酸铵反应后剩下硫酸。腐蚀性,硝酸铵剩硝酸,强氧化性。碳酸氢铵氨气与二氧化碳一起出来,不易分离。
5、硝酸铵在温度较高时,具有一定的氧化还原性,可发生自身氧化还原反应,根据温度不同,产物不同,甚至可能爆炸。
亚硝酸铵的理化性质
1、亚硝酸铵化学式NH4NO2,分子量6048 不稳定,常温时即逐渐分解为氮和水,受热时分解加快,浓溶液比干燥的晶体分解要快。当温度高于60℃时强烈的爆炸。
2、亚硝酸盐的致癌原理是亚硝酸根离子,它能够影响细胞核中DNA的复制,在细胞分裂时改变遗传物质,导致癌变。
3、亚硝酸K值氨水的K值。亚硝酸的酸性强,因此亚硝酸铵的溶液显酸性。
4、再者,亚硝酸铵的铵盐也可以生成氮气,(NH4NO2)但是条件难以控制,往往混杂着许许多多其他含氮的气体,如一氧化二氮,一氧化氮,但没有二氧化氮。
5、亚硝酸盐,是含有亚硝酸根阴离子(NO2)的盐。最常见的是亚硝酸钠,亚硝酸钠为白色至淡黄色粉末或颗粒状,味微咸,易溶于水。硝酸盐和亚硝酸盐广泛存在于人类环境中,是自然界中最普遍的含氮化合物。
6、如果相应的酸有氧化性,则分解出来的氨会立即被氧化。由于这些反应产生大量热,分解产物是气体,所以,它们受热往往会发生爆炸。铵盐中的碳酸氢铵、硫酸铵、氯化铵、硝酸铵都是优良肥料,硝酸铵又可用来制造炸药。
亚硝酸胺和硝酸胺什么区别?
硝酸铵外观为白色,无肉眼可见的杂质,可能微带黄色。总氮含量≥34%(Ⅱ级)。具有很强的吸湿性和结块性,大量的硝酸铵受热易分解。
硝酸铵极不稳定,在光照、碰撞或加热的条件下容易于爆炸并生成大量的氨气、氧气,并产生大量的热,和易然物放在一起容易发生火灾~硝酸铵210摄氏度左右分解成为氧化亚氮和水。操作时要特别注意温度变化。
亚硝酸胺 最不稳定 容易受热分解成水,一氧化氮,二氧化氮。其次是亚硝酸钾再潮湿环境下,会变硝酸钾。
腌制的蔬菜里面就会含有大量的亚硝酸盐。亚硝酸盐在胃酸的作用下会分解对人体有害的亚硝酸铵。亚硝酸铵才是引起人癌变的罪魁祸首。这并不代表说是腌制的食物一定会的癌症。癌症的发生与亚硝酸胺的很多因素有关。
解析:亚硝酸胺是最重要的化学致癌物之一。食物、化妆品、啤酒、香烟中都含有亚硝酸胺。在熏腊食品中,含有大量的亚硝胺类物质,某些消化系统肿瘤,如食管癌的发病率与膳食中摄入的亚硝胺数量相关。
硝酸盐具有3个氧原子,而亚硝酸盐则只有2个氧原子,硝酸盐相对更稳定,直到它被口腔中的细菌或体内的酶转化为亚硝酸盐。
亚硝酸铵的介绍
1、主要用途: 是氨氧化过程的中间体。熔点: 60~70(分解爆炸)沸点:相对密度(水=1): 1.69相对密度(空气=1):饱和蒸汽压(kPa):溶解性: 易溶于水、稀碱液和乙醇,不溶于醚。
2、亚硝酸盐可以和蛋白质分解产生的胺类物质形成亚硝胺,亚硝胺是强致癌物。硝酸盐和亚硝酸盐广泛存在于人类环境中,是自然界中最普遍的含氮化合物。
3、亚硝酸盐也是一种致癌物质,进入人体之后经过氧化会形成亚硝酸铵,亚硝酸铵进入肝脏之后会损伤肝细胞,进而导致肝脏癌变。
文章声明:以上内容(如有图片或视频亦包括在内)除非注明,否则均为网友提供,转载或复制请以超链接形式并注明出处。